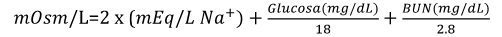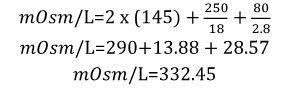|
La presión osmótica en la estabilidad y función celular
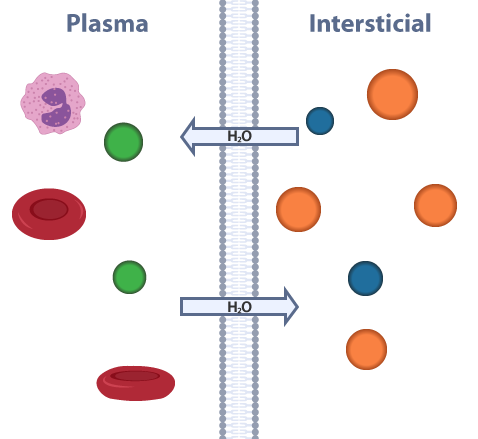
La ósmosis es una propiedad intrínseca de las soluciones. Es necesario mantener un equilibrio de los solutos presentes en el medio intra y extracelular. La ósmosis la podemos definir como la difusión pasiva del agua a través de una membrana semipermeable, desde la solución más diluida hacia una más concentrada. A partir de eso, podemos decir que la presión osmótica es aquella presión necesaria para detener el flujo de agua a través de la membrana semipermeable. Al considerar como semipermeable a la membrana plasmática, las células de los organismos pluricelulares deben permanecer en equilibrio osmótico con los líquidos tisulares que los bañan (plasma y líquido intersticial). Sin embargo, para comprender más este tema, primero debemos definir conceptos base como anión, catión y electrólito. En el siguiente esquema te mostramos el equilibrio osmótico entre el plasma y el líquido intersticial.
Equilibrio osmótico Los iones son átomos o moléculas que tienen una carga (positiva o negativa), ya que tienen números desiguales de protones y electrones. Si los átomos pierden electrones, se convierten en iones positivos (cationes). Por otro lado, si los átomos ganan electrones se convierten en iones negativos (aniones). A partir de la definición de un ion podemos decir que un electrolito se refiere a la capacidad de conducir corriente eléctrica gracias a la acción de iones, una característica peculiar de estas especies químicas. Sin embargo, en la medicina el término electrolito hace referencia a los iones presentes en la sangre y otros líquidos corporales. En el ser humano los solutos están representados por iones (Na+, K+, Cl-, Ca2+, Mg2+) y moléculas orgánicas de mayor peso molecular (glucosa, urea, proteínas) los cuales se distribuyen en diferentes proporciones entre los dos compartimientos principales, intracelular y extracelular. El cuerpo se mantiene en un equilibrio hidroelectrolítico, lo que significa que cada uno de los compartimentos tiene las mismas proporciones de agua y solutos. La osmolaridad del plasma sanguíneo humano es de 280-320 mOsm/L (1 Osmol = 1000 mOsmoles). En clínica, es común emplear la siguiente fórmula que nos da una aproximación al valor de la osmolaridad del plasma de una persona:
Fórmula 5
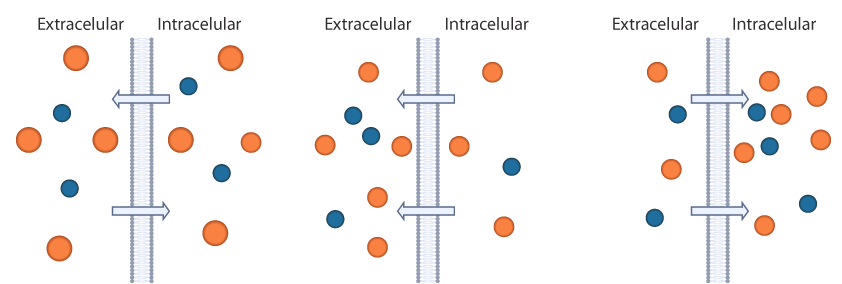
La capacidad de una solución de mover el agua hacia adentro o hacia afuera de una célula por ósmosis se conoce como su tonicidad. La tonicidad de una solución está relacionada con su osmolaridad, que es la concentración total de todos los solutos en la solución. En una situación fisiológica se define en términos de la concentración de las soluciones a ambos lados de una membrana: si la osmolaridad es igual de un lado y otro de la membrana se habla de soluciones isoosmóticas; si la solución extracelular tiene mayor concentración que la del interior de la célula es hiperosmótica. Finalmente, cuando la solución tiene menor concentración que la del interior de la célula se denomina hiposmótica. A continuación, te presentamos un esquema de una solución isoosmótica (izquierda), de una solución hiperosmótica (centro) y de una solución hipoosmótica (derecha). Las flechas representan el flujo de agua a través de la membrana celular.
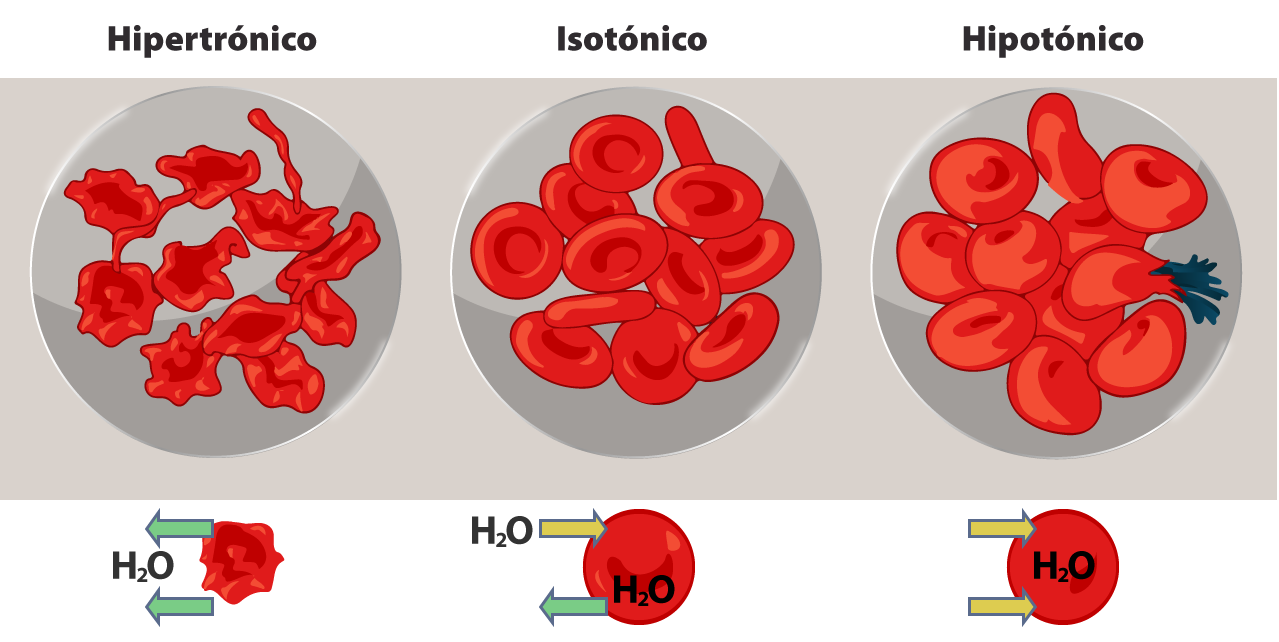
Esquema de una solución isoosmótica, hiperosmótica e hiposmótica Por otro lado, si se toma en cuenta el efecto sobre el volumen celular, cuando una solución no cambia el volumen de las células, se dice que es isotónica; si produce un aumento del volumen celular o inclusive la ruptura de la célula, la solución es hipotónica; mientras que, si induce una contracción del volumen de la célula por la salida de agua, es una solución hipertónica. Te presentamos un esquema donde se muestra el flujo de agua en un glóbulo rojo estando en una solución hipertónica (izquierda), en una solución isotónica (centro) y en una solución hipotónica (derecha).
LadyofHats. (2007). Osmotic pressure on blood cells diagram [illustrations]. Tomada de: https://en.wikipedia.org/wiki/Osmosis#/media/File:Osmotic_pressure_on_blood_cells_diagram.svg Un buen ejemplo es el de los glóbulos rojos (eritrocitos) suspendidos en soluciones de distinta concentración: cuando se colocan en agua o en soluciones salinas con menos de 280 miliosmoles por litro, los glóbulos rojos se hinchan debido al flujo de agua hacia su interior para igualar la concentración de solutos dentro y fuera del glóbulo. Como consecuencia de este flujo de agua, la membrana del eritrocito no resiste la presión y se puede producir la hemólisis (ruptura de los glóbulos rojos). Cuando estas células se colocan en soluciones con más de 320 miliosmoles por litro, los glóbulos pierden agua y se encogen alterando su morfología. Al poner a los eritrocitos en una solución con 280-320 miliosmoles por litro, entra y sale la misma cantidad de agua, manteniendo el equilibrio. La isotonicidad entre todas las células y los compartimientos líquidos debe mantenerse constante; cualquier alteración implica su corrección inmediata para regresar al equilibrio. Por ejemplo, si se bebe mucha agua y la sangre se diluye, la osmolaridad de esta baja y pasa más agua de la sangre a los tejidos; el organismo tiende a restablecer el equilibrio eliminando agua por vía renal. (责任编辑:) |